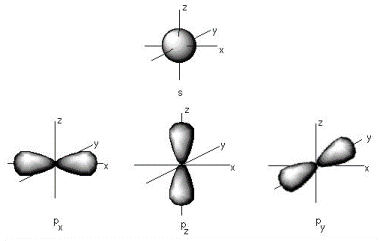
Mynd 1. Rafeindir hjá kolefni í grunnástandi er einungis að finna í s- og p-svigrúmum þess. 2p-svigrúmunum má skipta upp í 2px, 2py og 2pz.
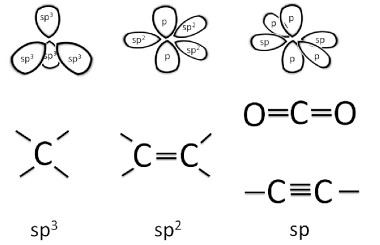
Mynd 2. Auk venjulegra samgildra tengja getur kolefni myndað tví- og þrítengi við önnur atóm vegna p-eiginleika í svigrúmum gildisrafeinda kolefnis.
- Mynd 1: Electronic Structure. (Sótt 12.10.2013).
- Mynd 2: Kristján Matthíasson.