Maður kemur til dæmis ekki jafn mörgum litlum og stórum hlutum fyrir í herbergi.Þetta er afar eðlileg spurning og ber vitni um skarpskyggni spyrjanda. Því er einmitt títt haldið fram að sami fjöldi gaseinda fyrirfinnist í einum lítra við sömu aðstæður. Svarið við þessari spurningu er hins vegar á þann veg að sú fullyrðing er ekki allskostar rétt og að efasemdir spyrjanda, sem greina má af spurningunni, eru fyllilega réttmætar. Fullyrðingin „að sami fjöldi gaseinda fyrirfinnist í einum lítra við sömu aðstæður" á einungis við um kjörgas (e. ideal gas) en ekki raungas (raunverulegar lofttegundir) (e. real gas). Kjörgas er einfalt líkan af gasi sem gerir ráð fyrir að rúmmál einda gassins sé óverulegt og að engir kraftar verki á milli eindanna. Þá gildir svonefnt kjörgaslögmál, sem rita má á forminu
n = PV / RT.Samkvæmt kjörgaslögmálinu er mólfjöldi gaseinda (og fjöldi gaseinda) (n) jafngildur margfeldi af þrýstingi (P) og rúmmáli (V) deilt með fastri tölu (R; gasfasti) og hitastigi (T; í Kelvingráðum). Samkvæmt þessu er mólfjöldi gaseinda (og þá fjöldi gaseinda) (n) einungis háður aðstæðum, það er þrýstingi (P), rúmmáli (V) og hitastigi (T) en óháður eiginleikum eindanna á borð við stærð þeirra. Þessa staðhæfingu má umorða og segja „að sami fjöldi gassameinda fyrirfinnist í einum lítra við sömu aðstæður" eins og fullyrðingin í spurningunni ber með sér. Þegar grannt er skoðað kemur hins vegar í ljós að þessu er ekki nákvæmlega svona farið með raunverulegt gas, einmitt vegna þess að eindir gassins, þótt smáar séu, taka nokkurn hluta rýmis gassins og á milli þeirra virka veikir kraftar. Samkvæmt kjörgaslögmálinu hér ofar væri margfeldi þrýstings (P) og rúmmáls fyrir 1 mól af kjörgasi (táknað Vm0 fyrir n = 1) deilt með RT fyrir fast hitastig, jafngilt einum, óháð þrýstingi, eða
1 = PVm0/RTEf á hinn bóginn framkvæmdar eru samtíma mælingar á rúmmáli og þrýstingi fyrir eitt mól af raungasi (Vm) og stærðin PVm/RT reiknuð út fyrir fast hitastig kemur í ljós að gildi önnur en einn geta fengist og þá mismunandi gildi eftir tegund gass og stærðar viðkomandi einda.
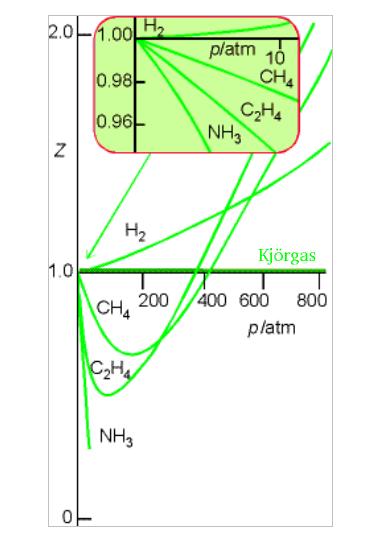
Þetta sést fyrir nokkrar gastegundir á myndinni hér að ofan þar sem ferlar yfir PVm/RT (=z) eru teiknaðir upp háð þrýstingi (P). Þetta er til vitnis um að kjörgaslögmálið gildir ekki fyllilega fyrir tilgreindar gastegundir. Í ljós kemur að frávik frá kjörgashegðun er lítið fyrir lágan þrýsting, en eykst með auknum gasþrýstingi. Því er réttara að fullyrða að „að nánast sami fjöldi gaseinda fyrirfinnist í einum lítra við sömu aðstæður svo fremi að gasþrýstingur sé lítill eða að gera megi ráð fyrir að kjörgaslögmálið gildi".
- Deviations from Idal Gas Law Behavior
- Van der Waals jafnan
- Atkins, Peter og de Paula, Julio. Physical Chemistry. 2002. Oxford University Press.
