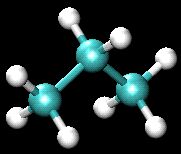
Hvernig er samsetning, uppruni og eðlismassi kósangass? Hvaða gastegundir myndast við bruna þess? Eru þær léttari eða þyngri en andrúmsloftið?Kósangas er öðru nafni nefnt própangas og er ýmist unnið úr jarðolíu eða með efnabreytingu á skyldu efni sem nefnist propene. Í gasinu eru sameindir með 3 kolefnisatómum (C) og 8 vetnisatómum (H) og er það því auðkennt með efnaformúlunni C3H8(g). Við sýnum hér líkanmynd af sameindinni. Einkennisbókstafurinn g táknar form eða ham efnisins, sem er gas. Eins og nafnið bendir til er efnið á loftkenndu formi við eðlilegar kringumstæður (staðalaðstæður, 25°C og 1 loftþyngdar þrýsting). Eðlismassi kósangass er um 1,9 grömm á lítra (g/l) við staðalskilyrði og er það því þyngra en loft, sem hefur eðlismassa um það bil 1,3 g/l við sömu aðstæður.
 Bruni kósangass felst í því að sameindir efnisins (C3H8(g)) ganga í efnasamband við súrefni andrúmsloftsins (O2(g)). Þegar bruninn verður þar sem gnægð er af súrefni í loftinu, eins og til dæmis utan dyra eða í vel loftræstu herbergi, rofna sameindir gassins og tengjast súrefnisatómum með þeim hætti að annars vegar myndast vatnssameindir sem þéttast og mynda vatn á vökvaformi, til dæmis sem vatnsdropa (H2O(l)), og hins vegar koltvíildi eða koltvíoxíð á gasformi (CO2(g)). Einkennisbókstafurinn l táknar að vatnið er í vökvaham og stendur fyrir upphafsstafinn í enska heitinu liquid. Þetta má tákna með eftirfarandi hætti:
Bruni kósangass felst í því að sameindir efnisins (C3H8(g)) ganga í efnasamband við súrefni andrúmsloftsins (O2(g)). Þegar bruninn verður þar sem gnægð er af súrefni í loftinu, eins og til dæmis utan dyra eða í vel loftræstu herbergi, rofna sameindir gassins og tengjast súrefnisatómum með þeim hætti að annars vegar myndast vatnssameindir sem þéttast og mynda vatn á vökvaformi, til dæmis sem vatnsdropa (H2O(l)), og hins vegar koltvíildi eða koltvíoxíð á gasformi (CO2(g)). Einkennisbókstafurinn l táknar að vatnið er í vökvaham og stendur fyrir upphafsstafinn í enska heitinu liquid. Þetta má tákna með eftirfarandi hætti:
 Koltvíildi er fyrir í andrúmsloftinu í litlu magni (dæmigert um 0,03%) og gegnir mikilvægu hlutverki í lífkerfi jarðarinnar. Það efni, ásamt vatni, er meginmyndefni öndunar og efnaniðurbrots lífvera og myndast meðal annars í fráöndun okkar mannanna. Koleinildi er hins vegar hættulegt lífríkinu, meðal annars vegna þess eiginleika sameindanna að geta bundist burðarsameindum súrefnis í blóði, hemóglóbínsameindunum. Koleinildissameindir geta bundist á þeim stað hemoglóbínsameindanna þar sem súrefnið á og þarf að bindast til að viðhalda eðlilegri öndun. Þannig geta CO sameindir hindrað öndun hjá lífverum og leitt til köfnunar og dauða.
Koltvíildi er fyrir í andrúmsloftinu í litlu magni (dæmigert um 0,03%) og gegnir mikilvægu hlutverki í lífkerfi jarðarinnar. Það efni, ásamt vatni, er meginmyndefni öndunar og efnaniðurbrots lífvera og myndast meðal annars í fráöndun okkar mannanna. Koleinildi er hins vegar hættulegt lífríkinu, meðal annars vegna þess eiginleika sameindanna að geta bundist burðarsameindum súrefnis í blóði, hemóglóbínsameindunum. Koleinildissameindir geta bundist á þeim stað hemoglóbínsameindanna þar sem súrefnið á og þarf að bindast til að viðhalda eðlilegri öndun. Þannig geta CO sameindir hindrað öndun hjá lífverum og leitt til köfnunar og dauða.

Koltvíildi (CO2(g)) hefur eðlisþyngd um 1,9 grömm per líter og er því þyngra en loft (1,3 grömm per líter), en koleinildi (CO(g)) hefur svipaða eðlisþyngd og loft (1,3 g/l). Koltvíildi getur verið hættulegt mönnum þó að það sé ekki eins bráðdrepandi og koleinildi. Vegna eðlismassans getur það til dæmis safnast fyrir í námugöngum og í kjöllurum eða lægðum í landslaginu í eldgosum og ýtt súrefni burt þannig að menn og dýr ná ekki að anda. Koltvíildi sem myndast við bruna á gasi í lokuðu herbergi getur hins vegar varla orðið mönnum að bana vegna þess að koleinildi fer að myndast vegna súrefnisskorts áður en menn kafna beinlínis úr honum. Heimildir: 1. Molecules eftir P.W. Atkins, Scientific American Library, (1987) 2. The Penguin Dictionary of Chemistry, D.W.A. Sharp, Penguin Books, (1983) 3. Handbook of Chemistry and Physics, 63. útgáfa, 1982-1983.
