 Efnatengi (e. chemical bond) nefnist samtenging tveggja atóma í sameind.
Efnatengi (e. chemical bond) nefnist samtenging tveggja atóma í sameind.Sameindir eru samsafn atóma (frumeinda) sem tengd eru saman með efnatengjum. Efnatengi milli atóma geta myndast ef orka samtengingarinnar er lægri en orka ótengdra atóma, það er ef samtengingin er orkustöðugra form en orka stakra atómanna.
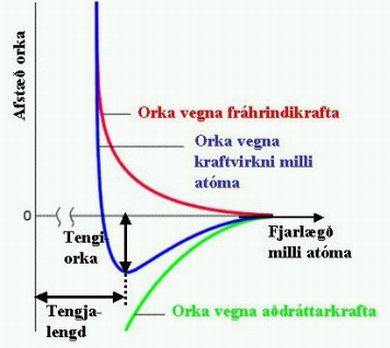
Þegar tvö atóm nálgast gætir í senn fráhrindi- og aðdráttarkrafta milli hlaðinna einda (atómkjarna og rafeinda) atómanna. Ef aðdráttarkrafturinn vegur meira en fráhrindikrafturinn, lækkar heildarorkan vegna kraftvirkninnar milli atómanna, þau dragast hvort að öðru og efnatengi getur myndast (sjá mynd hér fyrir neðan). Þegar nálægð atómanna verður mjög lítil eykst hins vegar vægi fráhrindikrafta umfram aðdráttarkrafta, einkum vegna skörunar neikvætt hlaðinna rafeinda atómanna. Þar sem fráhrindi- og aðdráttarkraftar eru jafnir er enginn nettókraftur og orkan nær lágmarki. Tilsvarandi fjarlægð milli atómanna nefnist tengjalengd efnatengisins og viðkomandi orkuminnkun kallast tengiorka (sjá mynd).
Rafeindaskipan gildisrafeinda atóma getur umbreyst við ofangreindan samruna.
- Þegar atóm sömu gerðar tengjast og mynda tvíatóma sameindir geta gildisrafeindir dreifst jafnt milli beggja atóma. Slík efnatengi nefnast samgild tengi (e. covalent bond) og dæmi um þau er til dæmis tengi milli súrefnisatóma í súrefnissameind (O2).
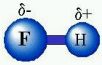
- Ef atóm eða sameindahópar ólíkrar gerðar tengjast efnatengi geta gildisrafeindir dreifst ójafnt milli atóma í efnatenginu. Þá myndast skautuð tengi (e. polar bonds). Dæmi um slíkt er vetnisflúoríð-sameindin (HF). Táknmynd á forminu:
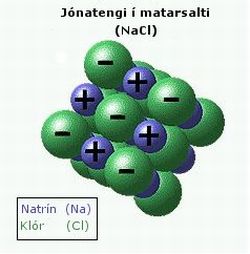
- Einnig geta rafeindir færst milli atóma og myndað jónir og jónatengi. Dæmi um slíkt er matarsalt (NaCl), sem einnig má tákna á forminu {Na+Cl-}.
- Loks má nefna efnatengi í málmum og málmblöndum þar sem gildisrafeindir dreifast milli fjölda atóma í kristal og mynda málmtengi.
- Hvað er rafdrægni? eftir Emelíu Eiríksdóttur
