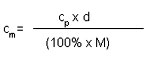
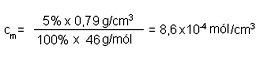
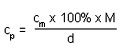
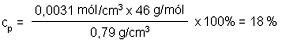
- Hvað er áfengiseitrun? eftir Bjarna Össurarson Rafnar.
- Hvað er áfengi lengi að fara úr líkamanum? eftir Þórdísi Gísladóttur og Þráin Hafsteinsson.
- Er maltöl áfengt og ef svo er, hver er styrkur alkóhóls í því? eftir Guðmund Mar Magnússon.
- Hvaða áhrif hefur alkóhól á heila og líkama? eftir Þuríði Þorbjarnardóttur.
- Er áfengi fitandi? eftir Björn Sigurð Gunnarsson.
- Housecroft, Catherine E. og Constable, Edwin C. 2006. Chemistry, þriðja útgáfa. Pearson education.
- McMurry, John. 2003. Fundamentals of organic chemistry, fimmta útgáfa. Cornell University.
Í heild sinni hljóðaði spurningin svona:
Hvernig er áfengisprósenta drykkja reiknuð? Hvernig er hún í samhengi við mólstyrk, til dæmis ef mólstyrkur etanóls er 3,1 M ?