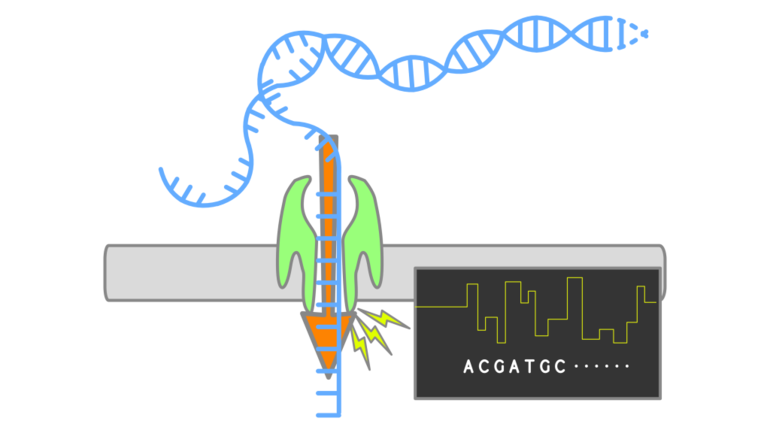
Skýringarmynd af veirugreiningarprófi LamPORE þar sem RNA er þrætt í gegnum örsmátt op í plasthimnu í tæki um leið og rafstraumur fer yfir himnuna. Mismunandi basar kjarnsýranna breyta straumnum mismikið og þannig er hægt að fá upplýsingar um basaröðina.
Eru þessar nýju aðferðir nógu áreiðanlegar?
Gagnrýnendur þessara nýju aðferða hafa bent á að þær hafi minni næmni en hefðbundna aðferðin, en um fimmtíu- til hundrað þúsund eintök af veiruerfðaefni þurfa að vera til staðar í sýnum til að greina veiruna með þeim, en aðeins þúsund eintök duga til greiningar með hefðbundnu aðferðinni. Aðrir hafa bent á að þau sýni sem hafi færri en hundrað þúsund eintök séu yfirleitt úr sjúklingum sem hafa jafnað sig á veirusýkingu og hafi þróað með sér mótefni gegn veirunni. Við fyrstu sýn virðist það mikill fórnarkostnaður að missa næmni á veiruna í upphafi sýkingar. Þar hafa vísindamenn þó bent á að það verði vissulega einhver tilvik sem sleppi í gegn, en að þau verði þó sárafá. Í upphafi meðgöngutíma veirunnar fjölgar hún sér ekki mjög hratt og þá er ekkert próf nógu gott til að nema hana, en þegar hún er á annað borð farin að fjölga sér með veldisvexti í öndunarvegi fólks er aðeins nokkurra klukkutíma munur á því hversu snemma núverandi tækni nemi veiruna miðað við hraðvirkari en minna næm próf. Það væri því jafnvel ódýrara að nota þessar aðferðir og prófa oftar til þess að grípa þá sem greinast neikvæðir í fyrsta prófi.[7][8] Einnig hafa verið uppi raddir um að það þurfi að setja aukinn kraft í að þróa ódýr heimapróf gegn veirunni sem einstaklingar gætu notað daglega. Þau próf yrðu ekki jafnnæm og prófin sem lýst er hér fyrir ofan en kosturinn er að þau væru það ódýr og einföld að unnt væri að nota þau í heimahúsi. Þannig væri hægt að grípa mun fleiri sýkingar en í núverandi ástandi þar sem afkastagetan er takmarkandi og smitrakning ekki gerleg. Við aðstæður þar sem margir koma saman í stórum hópum daglega, eins og í skólastarfi sér fólk fyrir sér að þetta gæti orðið mjög gagnlegt við að grípa sýkingar. Það á þó helst við í samfélögum þar sem mun verr hefur gengið að hemja útbreiðslu veirunnar en hér á landi.[9] Tilvísanir:- ^ Wölfel, R. o.fl. (2020). Virological assessment of hospitalized patients with COVID-2019. Nature, 581, 465–469. (Sótt 10.8.2020).
- ^ Þetta er nýstárleg tækni til raðgreiningar, en um hefðbundna DNA-raðgreiningu má lesa nánar í svari eftir Arnar Pálsson við spurningunni Hvað felst í því að skrá erfðamengi mannsins og hvað hefur það í för með sér? (Sótt 10.8.2020).]
- ^ Oxford Nanopore Technologies. LamPORE Assay. (Sótt 10.8.2020).
- ^ Arizti-Sanz, J. o.fl. (2020, 28. maí). Integrated sample inactivation, amplification, and Cas13-based detection of SARS-CoV-2. bioRxiv. (Sótt 10.8.2020).
- ^ SwabSeq — Octant. (Sótt 10.8.2020).
- ^ Bloom, J.S. o.fl. (2020, 6. ágúst). Swab-Seq: A high-throughput platform for massively scaled up SARS-CoV-2 testing. medRxiv. (Sótt 10.8.2020).
- ^ Larremore, B.D. o.fl. (2020, 27. júní). Test sensitivity is secondary to frequency and turnaround time for COVID-19 surveillance. medRxiv. (Sótt 10.8.2020).
- ^ Shaw, J. (2020, 3. ágúst). New Test Paradigm Needed for SARS-CoV-2. Harvard Magazine. (Sótt 10.8.2020).
- ^ Kotlikoff, L.J. & Mina, M. (2020, 3. júlí). Opinion - Coronavirus Testing the Cheap, Simple Way. The New York Times. (Sótt 10.8.2020).
- Nanopore sequencing - Wikipedia. (Sótt 10.08.2020).

