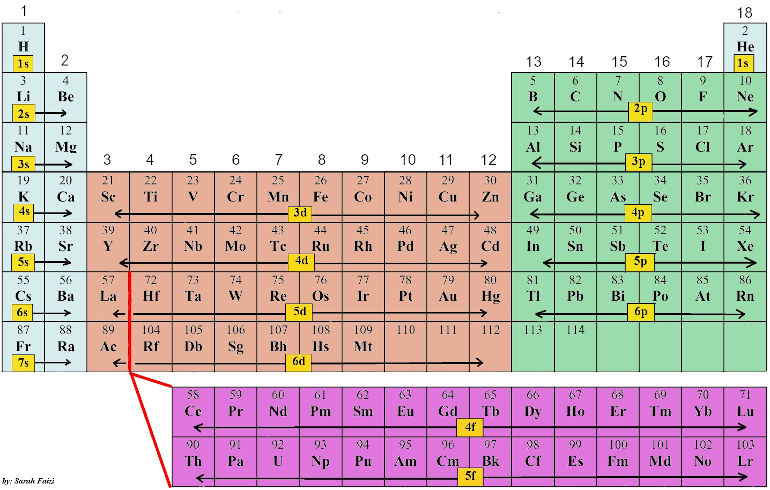
höfuð- skammtatala/ n |
||||||
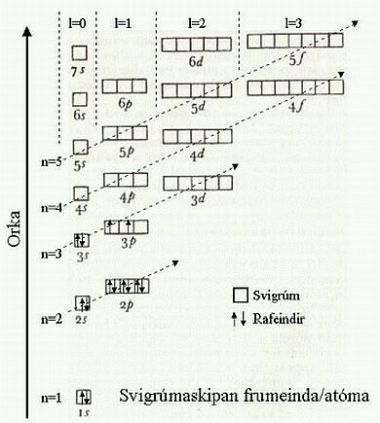
Mynd 1. Svigrúmaskipan frumeinda. Myndin skýrir í hvaða röð rafeindirnar raðast í svigrúmin. Pílurnar sýna röðun rafeindanna í atómum frumefnisins kísils (Si) sem hefur sætistöluna 14.
| Flokkur | ||||||||
| Fjöldi gildisrafeinda |
- Undirbúningur í efnafræði. Edbook. Háskóli Íslands. (Sótt 21.2.2023).
- Electron shell. Wikipedia(Sótt 21.2.2023).
- Mynd 1. Úr svarinu Hvaða skilyrði þarf frumefni að uppfylla svo það teljist málmur? eftir Emelíu Eiríksdóttur. (Sótt 21.2.2023).
- Mynd 2. What type of orbitals do actinides and lanthanides mainly use? Socratic. (Sótt 21.2.2023).