Eru til samsætur sem eru þannig að efnið verður allt öðruvísi þegar það bætast við nokkrar nifteindir eða ef efnið missir nokkrar nifteindir?Hvert frumefni (e. element) samanstendur af einni gerð frumeinda (e. atoms), það er frumeindum með sama fjölda róteinda (e. protons) í kjarnanum (e. nucleus). Fjöldi róteinda í kjarnanum segir til um hvert frumefnið er, þannig hafa allar vetnisfrumeindir eina róteind og allar súrefnisfrumeindir átta róteindir. Allar frumeindir tiltekins frumefnis hafa einnig sama fjölda rafeinda (e. electrons); fjöldi rafeinda í óhlaðinni frumeind er jafn fjölda róteinda í frumeindinni. Frumefni getur haft frumeindir með mismunandi fjölda af nifteindum (e. neutrons) og er þá talað um samsætur (e. isotopes). Samsætur hafa sömu sætistölu (e. atomic number) vegna þess að þær hafa sama fjölda róteinda en hins vegar hafa þær mismunandi atómmassa (e. atomic mass) og mismunandi massatölu (e. mass number) vegna þess að þær hafa mismunandi fjölda nifteinda. Sumar samsætur eru stöðugar meðan aðrar geta verið óstöðugar/geislavirkar. Hinar mismunandi óstöðugu samsætur geta sent frá sér mismunandi agnir og helmingunartími þeirra er ólíkur. Eiginleikar efna eru notaðir til að bera kennsl á efnin og lýsa þeim. Þessum eiginleikum má skipta í efnafræðilega eiginleika (e. chemical properties) og eðlisfræðilega eiginleika (e. physical properties). Efnafræðilegir eiginleikar efnis lúta að þeim eiginleikum sem koma fram þegar efnið tekur þátt í efnahvarfi og breytist í annað eða önnur efni. Sem dæmi um efnafræðilega eiginleika eru hvarfgirni (e. reactivity), oxun (e. oxidation), eldfimi (e. flammability), hvarfavarmi (e. reaction enthalpy), rafeindasækni (e. electron affinity), súrleiki (e. acidity) og oxunarástand (e. oxidation state). Efnafræðilegir eiginleikar frumefna ákvarðast af fjölda róteinda og rafeinda viðkomandi frumeindar. Frumefni með sama fjölda gildisrafeinda (e. valence electrons), það er rafeindir á ysta hvolfi, eru saman í flokki í lotukerfinu (e. periodic system) og hafa oft svipaða efnaeiginleika þar sem það eru gildisrafeindirnar sem taka þátt í efnatengjum. Frumefni í sama flokki taka því oft þátt í samskonar efnahvarfi þótt hraði og jafnvægi efnahvarfsins séu ekki eins. Sem dæmi um mismunandi efnafræðilega eiginleika frumefna þá er helín afar óhvarfgjarnt frumefni og ekkert á sér stað þegar það er blandað súrefni í mörg ár, á meðan járn myndar járnoxíð (ryð) með tíð og tíma. Samsætur sérhvers frumefnis hafa mun líkari efnafræðilega eiginleika en frumefni í sama flokki. Samsætur sérhvers frumefnis taka þátt í nákvæmlega sömu efnahvörfunum en þó getur verið munur á hvarfhraða og jafnvægi hvarfsins. Munurinn eykst með auknum hlutfallslegum massa samsætanna og kallast þessi munur samsætuáhrif (e. isotope effect). Munurinn er sem sagt meiri fyrir frumefni með lága sætistölu en háa; mestu samsætuáhrifanna gætir hjá vetni sem hefur sætistöluna 1. Eðlisfræðilegir eiginleikar efnis eru eiginleikar sem breyta ekki samsetningu efnisins við mælingu. Dæmi um eðlisfræðilega eiginleika eru litur, lykt, eðlismassi (e. density), mólmassi (e. molecular weight), harka (e. hardness), suðumark (e. boiling point), frostmark (e. freezing point) og rúmmál (e. volume). Það leikur enginn vafi á því að eðlisfræðilegir eiginleikar hinna mismunandi frumefni eru mismunandi. Helín er í gasfasa við herbergishita á meðan járn er í föstum fasa svo dæmi sé tekið um mismunandi eðlisfræðilega eiginleika frumefna. Flestir eðlisfræðilegir eiginleikar samsæta hvers frumefnis eru mismunandi, eins og atómmassi enda hefur hann að gera með samanlagðan massa nifteindanna og róteindanna í frumeindinni (rafeindirnar leggja ekki mikið til heildarmassans enda rafeindir um 1840 sinnum léttari - sjá svar sama höfundar við spurningunni Hver er massi róteindar í samanburði við massa rafeindar?) Þannig er atómmassinn 1,0078 amu fyrir vetni, 2,0141 amu fyrir tvívetni og 3,0160 amu fyrir þrívetni, sjá mynd 2 og töflu 1. Einnig getur munað einhverju á eðlismassa, bræðslumarki og suðumarki fyrir mismunandi samsætur frumefnis. Oft er hægt að nýta sér mun á eðlisfræðilegum eiginleikum samsæta til að aðgreina þær. Mestu munar vanalega á eðlisfræðilegum eiginleikum á milli samsæta léttari frumefnanna því þar er hlutfallslegur massamunurinn mestur.
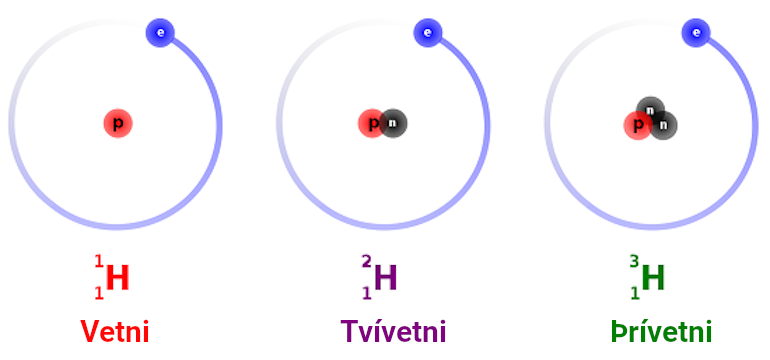
Mynd 2. Uppbygging vetnis, tvívetnis og þrívetnis.
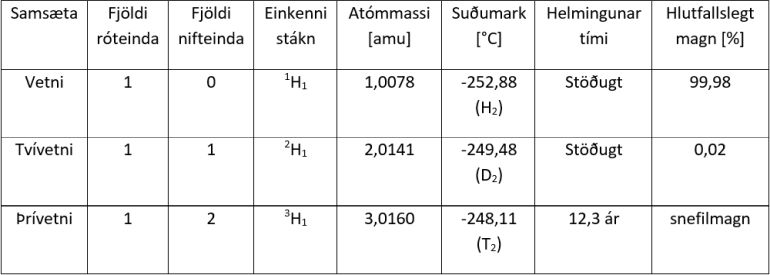
Tafla 1. Eiginleikar vetnissameinda.
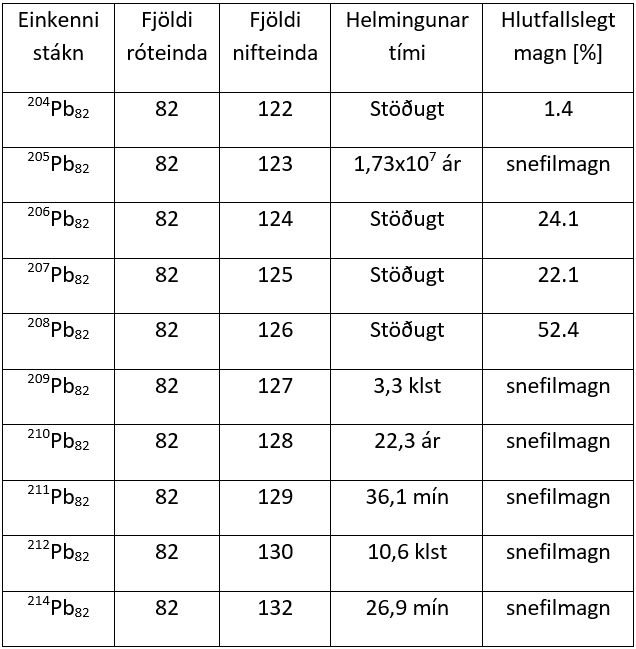
Tafla 2. Stöðugleiki náttúrulegra blýsameinda.
- Samsætur tiltekins frumefnis hafa sömu eða keimlíka efnafræðilega eiginleika.
- Vanalega er einhver munur á eðlisfræðilegum eiginleikum samsæta tiltekins frumefnis.
- Helsti munurinn á samsætum tiltekins frumefnis er yfirleitt stöðugleiki kjarnans, það er að segja sumar samsætur eru stöðugar á meðan aðrar eru geislavirkar.
- Samsæta tiltekins frumefnis er því ekki algjörlega frábrugðin hinum samsætum frumefnisins þó að einhver mælanlegur munur sé á sumum þeirra.
- Isotopes. Sótt 6.4.2020 af Toppr.com
- Isotopes: When the Number of Neutrons Varies. Sótt 6.4.2020 af Libretexts.
- Isotopes of hydrogen. Sótt 6.4.2020 af Wikipedia, frjálsa alrfæðiritinu.
- Properties of Hydrogen. Sótt 6.4.2020 af Libretexts.
- List of elements by stability of isotopes. Sótt 6.4.2020 af Wikipedia, frjálsa alfræðiritinu
- Lead. Sótt 6.4.2020 af Wikipedia, frjálsa alfræðiritinu.
- Pikrepo.com. Sótt 17.4.2020.

