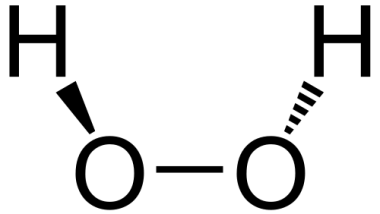
Mynd 1. Vetnisperoxíð er myndað úr einni peroxíðsameind og tveimur vetnisatómum.
- Chemistry, 8th Edition, Raymond Chang, (2005), McGraw Hill.
- Organic Chemistry, 6th Edition, John McMurry, (2004), Thomson,Brooks/Cole.
- Veal EA, Day AM, Morgan BA (April 2007). "Hydrogen peroxide sensing and signaling". Mol. Cell 26 (1): 1–14.
- Niethammer, Philipp; Clemens Grabher, A. Thomas Look & Timothy J. Mitchison (3 June 2009). "A tissue-scale gradient of hydrogen peroxide mediates rapid wound detection in zebrafish". Nature 459 (7249): 996–9.
- Municipal Wastewater Applications Using Hydrogen P | H2O2.com - US Peroxide - Technologies for Clean Environment. (Sótt 01.12.2013).
- Hydrogen peroxide - Wikipedia, the free encyclopedia. (Sótt 02.03.2014).